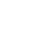專家觀點:聚焦造血干細胞移植
發布時間:2018-05-17作者:洛陽慈銘健康管理有限公司點擊:4384 次
造血干細胞移植(HSCT)是將健康的造血干細胞輸注給放、化療后的患者,以替代患者病態或衰竭的骨髓,使患者造血和免疫系統重建。HSCT由美國Fred Hutchinson癌癥研究中心的Thomas教授于20世紀50~70年代逐漸引入臨床,經過幾十年的發展,現已廣泛用于血液疾病。本文梳理HSCT預處理、移植方式以及術后反應的專家觀點。
造血干細胞移植預處理:增加強度還是合理選擇藥物?
造血干細胞移植是用于治療血液系統各種良、惡性疾病的有效方法。預處理是HSCT的開始,關系到移植的成敗。
以放療為基礎的預處理
全身放療(TBI)具有較強的免疫抑制作用和抗腫瘤活性作用,與化療藥物之間沒有交叉耐藥,能夠穿透中樞神經系統及睪丸等由于生理屏障造成的腫瘤細胞庇護所。較高劑量的TBI可以減低復發率,但是劑量過大會增加嚴重并發癥的發生。分次照射可以在減低器官毒性的同時保持抗腫瘤效應,因為正常組織比白血病細胞具有更強的損傷修復功能。
以化療為基礎的預處理
為了避免高劑量TBI的近期及遠期毒性,越來越多的醫療結構采用高劑量化療、馬利蘭(Bu)為基礎的預處理方案。Bu作為預處理方案的組成部分具有與TBI類似的優勢,它具有較廣譜的抗腫瘤作用,與其他烷化劑之間沒有交叉耐藥,而且可以透過血腦屏障,對中樞神經系統白血病具有預防和治療作用。Bu穩態血藥濃度與預后具有很強的相關性。口服Bu在不同個體間的穩態血藥濃度差異很大,被認為是肝靜脈閉塞病重要的高危因素,影響了Bu-Cy方案的療效,靜脈Bu的應用使Bu血藥濃度波動帶來的毒副反應明顯減少。
環磷酰胺(Cy)由于具有很強的免疫抑制活性,但大劑量Cy的應用會帶來很多致命毒副作用。氟達拉濱(Flu)具有免疫抑制作用強、髓外毒性小的優點,具有一定的抗腫瘤作用,并且可以抑制烷化劑誘導的DNA損傷的修復,與烷化劑合用可增強后者的抗腫瘤效果。Flu替代Cy可保留免疫抑制作用,同時避免Cy與Bu聯用導致的髓外毒性。
馬法蘭(Mel)具有免疫抑制作用和廣譜抗腫瘤效應,是多發性骨髓瘤和淋巴瘤患者預處理方案的主要組成藥物。中國醫學科學院血液病醫院移植中心的臨床資料發現,在AML的異基因移植中,Bu+Mel+Flu+Ara-C方案與Bu+Cy+Flu+Ara-C預處理方案相比,復發率更低(4.3% vs 25.0%,P=0.009)。
疾病診斷和狀態、有無并發癥、患者年齡、排斥風險、復發風險等均影響預處理方案的選擇。因病種而異、因人而異的更加個體化的預處理方案選擇是本領域研究最終追求的目標。
難治/復發型急性白血病的挽救性移植具臨床價值
急性白血病發生難治/復發的主要原因是白血病細胞對化療產生耐藥性,涉及多方面的機制,預后極差,目前尚無標準的挽救性治療方案可循。根據國內外研究進展、專家共識和指南推薦,結合患者年齡、體能狀況和個人意愿,難治/復發的白血病患者可以考慮納入臨床研究或者接受異基因造血干細胞移植。下面著重介紹造血干細胞移植技術治療難治/復發的急性白血病的移植方式和預處理方案。
目前用于移植的造血干細胞主要來源于骨髓、外周血和臍帶血,已經明確的是去除移植物中的T細胞可減少移植物抗宿主病的發生率與嚴重程度,但移植排斥率、感染率和復發率均明顯增加。對于病情進展惡化較快、亟需快速進行移植的難治/復發患者,非去T的單倍體移植方式是很好的治療選擇。
傳統的清髓性預處理方案是以清空骨髓和促進植入為目的,尚不足以徹底清除患者體內高負荷的白血病細胞,移植后復發率高達40%~70%。改良的清腫瘤預處理方案是在傳統方案中添加抗腫瘤藥物,故亦被稱為強化預處理方案,旨在可接受的毒性強度下增強抗腫瘤作用,在移植前進一步清除難治/復發患者體內殘留的白血病細胞,以提高移植生存率。
某省血液病診療中心自2013年始,應用由氟達拉濱與阿糖胞苷序貫預處理的FA5-BUCY方案治療難治/復發病例,2年OS可達61.2%;不同移植類型(全相合、單倍體)和不同白血病負荷(移植時骨髓原始細胞≤20%、>20%)的移植療效基本相近;其中,移植前經化療和酪氨酸激酶抑制劑(TKI)未能獲緩解的Ph陽性急淋患者,其DFS與緩解病例相近(DFS:16.7% vs 56%,P=0.021),相比于Ph陰性急淋患者有更為顯著的移植后GVL效應。
該結果再次肯定了挽救性移植的臨床價值,高腫瘤負荷狀態的難治/復發患者也并非完全沒有治療機會,同時也發現挽救性移植在臨床應用中還面臨諸多挑戰,需要進一步通過優化治療策略以提高長期療效和安全性。
- 上一篇:智慧護理 曙光照進現實



 豫公網安備 41030502000297號
豫公網安備 41030502000297號